Гальванічний елемент у банку
Гальванічний елемент у банку
Вольтів стовп являє собою батарею з безліччю гальванічних елементів. У стовпі, про який йшла мова, гальванічні елементи — срібно-цинкові. Такі ж елементи можуть бути створені і з допомогою інших пар металів. Достатньо, щоб вони вдало поєднувалися. Не слід забувати також і про тонкому вологому картоні: без нього елемент не буде працювати (тобто, звичайно, якщо опустити два різних металу в рідину).
Якщо занурити метал у воду, його атоми будуть прагнути перейти в розчин у вигляді позитивно заряджених іонів (катіонів). При цьому поверхня металу заряджається негативно, і вона починає притягувати позитивно заряджені іони вже перейшли у воду. З-за негативного заряду поверхні металу, подальший перехід іонів в розчин припиняється (настає динамічна рівновага тобто скільки перейшло в розчин стільки і повернулося), і на негативній поверхні утворюється шар з позитивно заряджених іонів металу, так званий подвійний електричний шар (ДЕС). Якщо занурити два різних металу то вони зарядяться обидва, але залежно від активності металу, один сильніший, а інший слабкіший. Якщо з'єднати ці, по-різному заряджені метали провідником, з-за різниці потенціалів потече потік електронів від «слабкої» до «сильного». В результаті «слабкий» метал (більш активний) почне розчинятися (іони переходять у розчин, а на «сильному» металі іони відновлюються і осідають на поверхні.
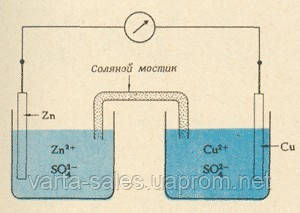
Вольта зробив відкриття: дав нам у руки гальванічний елемент. Давайте і ми сконструируем гальванічний елемент. Візьмемо два металеві електроди, потенціали яких значно різняться. Вчинимо так само, як Даніель, ім'ям якого названий мідно-цинковий елемент. Зануримо мідний і цинковий електроди в розчини сульфатів з концентрацією іонів 1 моль/л. Стандартний потенціал цинкового електрода — 0,76, а мідного — 0,34 Ст. Напруга отриманого елемента буде дорівнює 0,34 — (-0,76) = 1,1 Ст. Візьмемо мідну дріт, з'єднаємо обидва електрода, підключимо навіть прилади для вимірювання напруги і струму, але стрілка завмерла, струму немає. Ми забули з'єднати електроди і «по воді». З'єднаємо склянки з розчинами так званим електролітним мостом. Він являє собою тонку скляну трубочку, наповнений електролітом, наприклад KCl. Перегородки, поставлені на обох кінцях трубки, заважають вільному переходу іонів з одного розчину в інший. Іони міді не можуть самостійно перейти в розчин сульфату цинку і, навпаки, іони цинку не можуть перейти в розчин сульфату міді. Не можна допустити, щоб розчини змішалися.
Мідно-цинковий гальванічний елемент з електролітним мостом
Мідно-цинковий гальванічний елемент з електролітним мостом
Після того, як поставлено електролітний міст, гальванічний елемент починає працювати: по ланцюзі тече електричний струм. На одному електроді, там, де цинк занурений в розчин сульфату цинку, відбувається постійне розчинення металу і рух іонів цинку в розчині:
Zn — 2e- → Zn2+
а на іншому електроді постійно виділяється мідь:
Cu2+ + 2е → Cu
Цинк окислюється, а іони міді відновлюються. Для цинку необхідно, щоб яка-небудь речовина прийняло електрони, від яких він прагне звільнитися. Іони міді, навпаки, потребують таких електронах. Ці електрони рухаються по зовнішньому ланцюзі, по провіднику, що з'єднує два електрода. Рух потоку електронів по провіднику — це і є електричний струм. Таким чином, за рахунок хімічного процесу:
Zn + Cu2+ → Zn2+ + Cu
виробляється електрична енергія.
Але для чого потрібен електролітний (сольовий) міст. Без такого мосту гальванічний елемент не працює. Які зміни відбуваються поблизу цинкової пластинки, коли з її поверхні відриваються іони цинку. Природно, що концентрація цих іонів в розчині збільшується. З'являється велика кількість позитивних іонів, яким немає антиионов в розчині. Чули про таке — розчин, що містить переважно однаково заряджені іони? Швидше за все, немає. Розчини самі по собі електронейтральні. Аналогічні зміни настають і в об'ємі розчину, у який занурена мідна пластинка. Тут зайвими стають сульфатні аніони SO42-, тобто розчин заряджається негативно. Електрони перейшли від одного електрода до іншого і порушили электронейтральность розчину. Ця різниця потенціалів повинна бути усунена. Цьому сприяє електролітний міст. За нього аніони SO42 - переходять від мідного електрода до цинкового чинності цієї самої різниці потенціалів, але якщо бути більш точними, в нашому випадку аніони SO42 - переходять в сольовий міст, з одного боку, а з іншого боку виходять аніони Cl-. Таким чином, у наявності два потоку: потік електронів на зовнішньому провіднику і потік іонів за електролітним мосту.
Ні мідний стрижень, ні ZnSO4 не є обов'язковою частиною цього елемента. Металева мідь осідає на катоді з будь-якого іншого провідника, наприклад на платиновій дротині, а розчин сульфату цинку в анодній камері можна замінити будь-якій іншій провідній сіллю, яка не взаємодіє з цинковим анодом, наприклад, хлоридом натрію. Як соляного містка, можна використовувати скляну U-образну трубку, що містить який-небудь типу електроліт KNO3, змішаний з агар-агаром або желатиной, щоб утримати електроліт в трубці.
Якщо обидва металу занурити в загальний розчин, що містить два виду іонів. Занурити зрозуміло, можна, тільки обмін електронами буде на поверхні цинку, а не через зовнішній ланцюг. Цинк почне розчиняться поступово вкриваючись ямками, в теж час покриваючись скоринкою міді, яка сформує губчасте коричневе покриття. Але сольовий місток створює опір дифузії іонів, створюючи електричний опір, що заважає отриманню сильного струму від елемента, тому найкращий пристрій елемента, за умови його нерухомості, ґрунтується на гравітаційне розділення розчинів без будь-яких перегородки між ними. В такому елементі розведений розчин ZnSO4 обережно заливають поверх концентрованого, більш щільного розчину CuSO4. При нерухомому стані і відсутності вібрацій елемент працює дуже добре. Внутрішній опір такому елементі майже повністю відсутня, і це дає можливість отримувати великі струми. Такий елемент Даніеля раніше широко використовувався в якості стаціонарного джерела струму на телеграфних станціях і в будинках для дверних дзвінків. Подібний елемент можна зробити і іншим способом. Скляна банка заливається концентрованих розчинів кухонної солі (NaCl). Біля дна банки розміщується мідний електрод, а нагорі цинковий. На дно банки акуратно опускаються кристали CuSO4. Сульфат міді, розчиняючись на дні, з концентрованим розчином NaCl змішується повільно, з-за цього іони Cu2+ не досягають цинкового електрода.
Мідно-цинковий гальванічний елемент в одній банці без перегородок
Мідно-цинковий гальванічний елемент в одній банці без перегородок
Як ми бачимо, для того, щоб електрони могли зробити корисну роботу, потрібно змусити їх рухатися по зовнішньому ланцюзі.
В принципі, будь-окислювально-відновний процес може дати свій гальванічний елемент. Адже кожна пара характеризується своїм окислювально-відновним потенціалом. Вибираємо дві такі пари, розташовуємо їх як електроди, з'єднуємо відповідним чином і елемент готовий. Він буде працювати. Є тільки одна складність — як зробити електрод. З металами це не складно. Занурюємо їх у розчин їх солі, і електрод сконструйований. З деякими газами це також виявляється справою можливим. Але існує багато інших окислювально-відновних процесів, при яких конструювання відповідних електродів зовсім не просто.
Не знаю, чи звернули Ви достатню увагу на ту обставину, що електродний потенціал (за рівнянням Нернста і Петерса) в чималому ступені залежить від концентрації іонів у розчині. Не можемо ми і з цього витягти користь? Раз електродний потенціал залежить від концентрації, то при зануренні одного і того ж металу в розчини його іонів різної концентрації можна отримувати різний електродний потенціал. З таких електродів можна зробити і гальванічний елемент. Називають його концентраційний гальванічний елемент. Беремо, наприклад, дві мідні пластинки і занурюємо їх в розчини з концентрацією мідних солей відповідно 2 моль/л та 0,2 моль/л (у розрахунку на іон міді). Ставимо електролітний міст. З'єднуємо електроди провідником. Елемент починає працювати. На одному електроді, там, де концентрація іонів міді в розчині нижче, відбувається безперервне розчинення міді:
Cu — 2e- → Cu2+
При цьому мідь окислюється, концентрація іонів міді в розчині постійно підвищується. На іншому електроді відбувається зворотний перехід — іони міді з розчину осідають на поверхню металу:
Cu2+ + 2e- → Cu
Іони міді відновлюються, їх концентрація в розчині безперервно зменшується. Отже, концентраційний гальванічний елемент працює за рахунок різниці концентрації іонів міді в обох електродів, поки концентрації іонів у двох електродів не стануть рівними. Тоді зникне і різниця електродних потенціалів, отже, не буде і напруги. Можна додати до одного з двох розчинів воду, щоб змінилася концентрація солі. Знову виникне різниця електродних потенціалів, і гальванічний елемент знову запрацює. Можна навіть поміняти знаки біля електродів. Концентраційні гальванічні елементи рідко використовуються на практиці, оскільки при їх виготовленні як різних, так і однакових окисно-відновних пар (при різній концентрації відповідних іонів у розчині), важко врахувати вплив, залежить від концентрації, доданку до рівняння Нернста.
- Батарейки Mint Energy заряджаються від руху!!!
 Акумулятори заряджаються при русі!!!Повна версія статті
Акумулятори заряджаються при русі!!!Повна версія статті




